En una decisión históricamente vergonzosa, la FDA se convirtió recientemente en el único organismo regulador internacional en autorizar el uso de vacunas de ARNm de Moderna y Pfizer para niños de seis meses a cinco años.
Para la gran mayoría de los niños pequeños y los niños pequeños, es probable que no haya justificación o necesidad de esta autorización.
Tienen un riesgo muy pequeño de sufrir complicaciones graves por la COVID, lo que significa que el cálculo de riesgo-beneficio es precario en el mejor de los casos y potencialmente negativo en el peor.
También es un testimonio de la politización inquietantemente exitosa de las agencias reguladoras de EE. UU. que esencialmente ningún otro país respetado internacionalmente en ninguna parte del mundo ha tomado esta desconcertante decisión.
Suecia, por ejemplo, ha detuvo el despliegue de la vacuna Moderna para cualquier persona menor 30.
No 18. No 12. No 5. 30.
Estados Unidos va a vacunar ahora a niños de hasta seis meses de edad con el mismo producto que Suecia ha prohibido para cualquier persona menor de 30 años, citando efectos secundarios que inclinan las cifras de riesgo-beneficio.
A pesar de esta preocupante diferencia de opinión, el Jefe de Gabinete de la Casa Blanca/Presidente Interino Ronald Klain celebró el anuncio de manera confusa:
Curiosamente, The New York Times El enlace que Klain tuiteó sacó a relucir otro aspecto preocupante del proceso de autorización, que requiere un examen de los documentos y declaraciones anteriores de la FDA.
La primera información interesante de la comunicado prolongado de la FDA es su estimación de la eficacia de la vacuna para los grupos de mayor edad.
Los números son... sombríos:
Las estimaciones observadas de la efectividad de la vacuna contra la enfermedad sintomática debida a la variante Omicron incluyen lo siguiente: 8.8 % (IC del 95 %, 7.0 a 10.5) a las 25 o más semanas desde la vacunación primaria en adultos; 59.5% entre adolescentes de 12 a 15 años de 2 a 4 semanas después de la dosis 2, 16.6% durante el mes 2 después de la segunda dosis y 9.6% durante el mes 3 después de la segunda dosis
8.8% de efectividad contra la enfermedad sintomática después de ~6 meses entre adultos.
dentro de sólo dos meses de vacunación, la efectividad contra la enfermedad sintomática entre los 12 y los 15 años cae al 16.6% y al 9.6% al tercer mes. No especifican la efectividad posterior, presumiblemente porque cae al cero por ciento o incluso se vuelve negativa.
Además, sus estimaciones de la efectividad de la vacuna contra las hospitalizaciones y las visitas al departamento de emergencias son dramáticamente más bajas que las tasas del 95-100 % afirmadas por los "expertos" que se utilizaron para justificar la discriminación y los horribles llamados para excluir a los "no vacunados" de la atención médica:
Las estimaciones observadas de la eficacia de la vacuna de ARNm de la serie primaria contra las hospitalizaciones debidas a la variante Omicron en adultos se han informado en un 41 %-57 % a los 6-9 meses o más después de la segunda dosis.
En un estudio observacional entre adolescentes de 12 a 18 años (intervalo medio desde la vacunación, 162 días) durante el período predominante de Omicron, la efectividad de la vacuna de la serie primaria fue del 40 % (IC del 95 %, 9 a 60) contra la hospitalización por COVID-19
Las estimaciones observadas de la eficacia de la vacuna de ARNm de la serie primaria contra las visitas al departamento de emergencias/atención de urgencia debido a la variante de Omicron en adultos se informaron entre 31 % y 38 % a los 6 a 9 meses o más después de la segunda dosis.
Cualquiera que sea el porcentaje de eficacia declarado antes de Omicron, estos porcentajes se reducen considerablemente en comparación con las expectativas.
Tan bajo como 41% para la eficacia de la vacuna contra la hospitalización para adultos de 6 a 9 meses o más después de la segunda dosis.
Departamento de emergencia o atención de urgencia tan bajo como 31%. 40% con un intervalo de confianza de 9-60% para adolescentes de 12-18 años.
Esta es otra razón más por la cual los mandatos basados en la vacunación son completamente indefendibles:
Estos números son notablemente bajos y fallarían al objetivo original del 50 % que la FDA fijó para la autorización de emergencia de las vacunas contra el COVID.
¿Recuerdas la parte preocupante que mencioné anteriormente sobre el proceso para niños pequeños?
Los porcentajes de efectividad no solo no alcanzan su umbral del 50 % en adultos, sino que para los niños, simplemente desecharon ese estándar.
Con el fin de autorizar la vacuna para grupos de edad más jóvenes, la FDA imputó la eficacia de la vacuna mediante "inmunopuente" y comparando la generación de anticuerpos de grupos de mayor edad:
La eficacia de la vacuna se infirió mediante inmunopuente en función de una comparación de los criterios de valoración de la inmunogenicidad (concentraciones medias geométricas (GMT) de anticuerpos neutralizantes del SARS-CoV-2 y tasas de respuesta serológica 1 mes después de la dosis 3) entre participantes de 6 a 23 meses de edad del estudio C4591007 (n= 146) y participantes de 16 a 25 años de edad del estudio C4591001
Esencialmente, aunque la creación de anticuerpos claramente no es suficiente para prevenir la infección sintomática o alcanzar las estimaciones originales del 95 %, la FDA infirió la efectividad de la vacunación entre bebés y niños pequeños en función de las comparaciones de generación de anticuerpos.
En este punto, ya es obvio por qué EE. UU. va a ser el único país occidental en comenzar con las vacunas de ARNm para niños tan pequeños.
La presión política del presidente interino Klain, activistas como Ashish Jha, Jeremy Faust, Jerome Adams y otros es indudablemente peligrosa.
Esto podría explicar potencialmente por qué la FDA cambió el objetivo del 50 % de eficacia a la generación de anticuerpos, para someterse a la presión política de la Casa Blanca y sus aliados en los medios y la comunidad de "expertos".
El mes pasado, Vinay Prasad detalló lo absurdo de esta decisión:
También menciona que la meta del 50% inicialmente determinada fue “arbitraria” y bastante baja.
La efectividad de las vacunas contra la hospitalización durante la era Omicron para aquellos que están “totalmente vacunados” es inferior que eso, e infirieron la eficacia entre los niños pequeños en función de la generación de anticuerpos en esos mismos grupos de edad.
En resumen, descartaron su objetivo determinado arbitrariamente, que ya era bajo, y luego imputaron la eficacia en función de un punto final (generación de anticuerpos) que ya hemos visto que no funciona particularmente bien contra la variante dominante actual.
Claro, esto es extremadamente desconcertante y frustrante, pero bueno, al menos Ron Klain está feliz.
inmunidad natural
La FDA en su infinita sabiduría también ignoró las propias estimaciones de los CDC, que afirman que el 75 % de los niños ya han tenido COVID:

Por supuesto, nadie involucrado en este proceso de toma de decisiones está dispuesto a reconocer que el 75 % de los niños se infectaron con COVID a pesar del uso de cubrebocas, el cierre de escuelas y otras “intervenciones” diseñadas para prevenir o “ralentizar” la propagación del virus. Pero yo divago.
Es probable que la inmunidad natural proteja más contra futuras infecciones que la vacunación, como explica este tuit de Tracy Høeg basado en datos de un estudio del New England Journal of Medicine:
La FDA se apresuró a autorizar las vacunas para niños extremadamente pequeños en función de la respuesta de anticuerpos en lugar de las estimaciones de eficacia, ignorando que el 75 % de los niños pequeños ya tenían una mejor protección.
Es una clínica en lo que no se debe hacer.
Estimaciones de eficacia real
La FDA generó algunas estimaciones de la eficacia de la vacuna para las edades de 6 a 23 meses y de 2 a 4 años y las cifras a las que llegaron muestran por qué tuvieron que recurrir a la respuesta de anticuerpos en lugar de una reducción real comprobada.
Participantes de 6 a 23 meses de edad
Un análisis de eficacia descriptivo preliminar de los casos de COVID-19 que ocurrieron al menos 7 días después de la dosis 3 entre los participantes de 6 a 23 meses de edad en la población de eficacia evaluable de la dosis 3 incluyó un total de 3 casos confirmados acumulados en participantes con y sin evidencia de antecedentes. Infección por SARS-CoV-2 hasta el corte de datos del 29 de abril de 2022. La población de eficacia evaluable de la dosis 3 incluyó a 376 participantes aleatorizados a BNT162b2 y 179 participantes aleatorizados a placebo. La estimación de VE en este análisis preliminar fue del 75.6 % (IC del 95 %: -369.1 %, 99.6 %), con 1 caso de COVID-19 en el grupo de BNT162b2 en comparación con 2 en el grupo de placebo (aleatorización 2:1 de BNT162b2 a placebo).
Énfasis añadido
Hubo 1 caso en el grupo de vacunación y 2 en el grupo placebo. Eso es todo.
Así es como se llega a intervalos de confianza de -369.1 % a 99.6 %. La vacuna podría tener una eficacia negativa de casi el 400 % para los bebés, o podría ser una de las mejores vacunas jamás creadas con una eficacia casi perfecta. ¡Quién sabe! Ciertamente no la FDA basada en 3 casos totales de COVID en este grupo de edad.
Pero no se preocupe, recopilaron muchos más datos para el grupo de edad de 2 a 4 años.
Ese conjunto de datos tenía 7 casos en total:
Participantes de 2 a 4 años de edad
Un análisis de eficacia descriptivo preliminar de los casos de COVID-19 que ocurrieron al menos 7 días después de la dosis 3 entre los participantes de 2 a 4 años de edad en la población de eficacia evaluable de la dosis 3 incluyó un total de 7 casos confirmados acumulados en participantes con o sin evidencia de antecedentes.
Infección por SARS-CoV-2 hasta el corte de datos del 29 de abril de 2022. La población de eficacia evaluable de la dosis 3 con y sin evidencia de infección previa por SARS CoV-2 incluyó 589 participantes asignados al azar a BNT162b2 y 271 participantes asignados al azar a placebo. La estimación de VE en este análisis preliminar fue del 82.4 % (IC del 95 %: -7.6 %, 98.3 %), con 2 casos de COVID-19 en el grupo de BNT162b2 en comparación con 5 en el grupo de placebo (aleatorización 2:1 de BNT162b2 a placebo). Un caso confirmado en el grupo de placebo ocurrió en un participante con evidencia de infección por SARS-CoV-2 antes de los 7 días posteriores a la dosis 3.
¡Bueno, al menos tenemos una posible eficacia negativa del 8% en los intervalos de confianza!
Pero, de nuevo, no se preocupe, la FDA es consciente de esta limitación y de muchas más:
En un análisis combinado de ambos grupos de edad, la EV fue del 80.4 % (IC del 95 %: 14.1 %, 96.7 %) con 3 casos en el grupo BNT162b2 y 7 casos en el grupo placebo. La interpretación de los datos de eficacia posteriores a la dosis 3 para ambos grupos de edad, y para el grupo de edad de 6 meses a 4 años en general, está limitada por las siguientes razones:
- La eficacia de la vacuna posterior a la dosis 3 no se puede estimar con precisión debido al número limitado de casos acumulados durante el seguimiento a ciegas, como se refleja en los amplios intervalos de confianza asociados con las estimaciones.
- Estos datos descriptivos de eficacia son preliminares, ya que aún no se han logrado los 21 casos especificados en el protocolo.
- Hubo intervalos de dosificación muy variables entre las dosis 2 y 3, con intervalos medianos de 112 (rango 56 a 245) días entre los participantes de 6 a 23 meses de edad y 77 (rango de 42 a 239) días entre los participantes de 2 a 4 años de edad en la población de eficacia evaluable de la dosis 3.
- La mediana del tiempo de seguimiento ciego posterior a la dosis 3 en los análisis fue de solo 35 días para los participantes de 6 a 23 meses de edad y de 40 días para los participantes de 2 a 4 años de edad.
El protocolo especificó 21 casos que no se lograron. ¡Pero de todos modos autorizaron las vacunas!
Entre el grupo de edad de 2 a 4 años, hubo una tasa significativamente mayor de casos que “cumplían con los criterios de COVID-19 grave” en el grupo que recibió la vacuna:
Siete casos en participantes de 2 a 4 años de edad cumplieron con los criterios de COVID-19 grave: 6 en el grupo BNT162b2, de los cuales 2 casos ocurrieron después del desenmascaramiento, y 1 en el grupo placebo.
Esto no implica que quienes se vacunan sean más, probablemente tenga un caso grave de COVID, pero una vez más subraya el problema de tamaños de muestra tan pequeños y el abandono de los objetivos originales.
Y cabe señalar que se determinó que los casos graves no eran "clínicamente significativos":
Todos los cuales fueron considerados por el investigador como clínicamente no significativos según el examen en la visita de enfermedad y las circunstancias contribuyentes, como el llanto del participante durante el examen.
Las tablas de datos
La FDA sabe que la mayoría de los estadounidenses nunca mirarán las tablas de datos, especialmente aquellos en la clase de "expertos" de los medios y activistas de Twitter.
Pero cualquiera que los examine puede comprender de inmediato lo absurdo del proceso de toma de decisiones de la FDA:
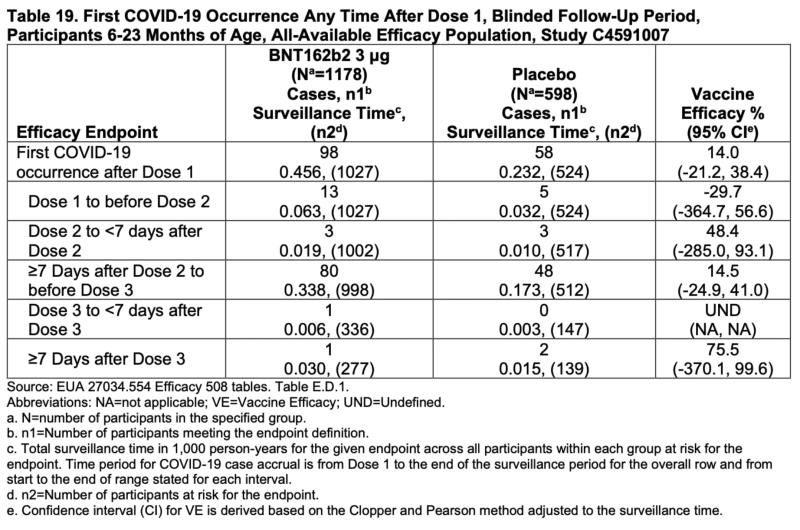
Los intervalos de confianza para cada cálculo de eficacia individual para participantes de 6 a 23 meses caen por debajo de cero. Cada uno.
La estimación general es del 14% e incluso eso podría ser tan bajo como -21.2%.
Es simplemente risible. Bueno, sería ridículo si no fuera una decisión tan importante.
Si desea ser caritativo, al menos el porcentaje de eficacia general para las personas de 2 a <5 años no tuvo intervalos de confianza negativos:
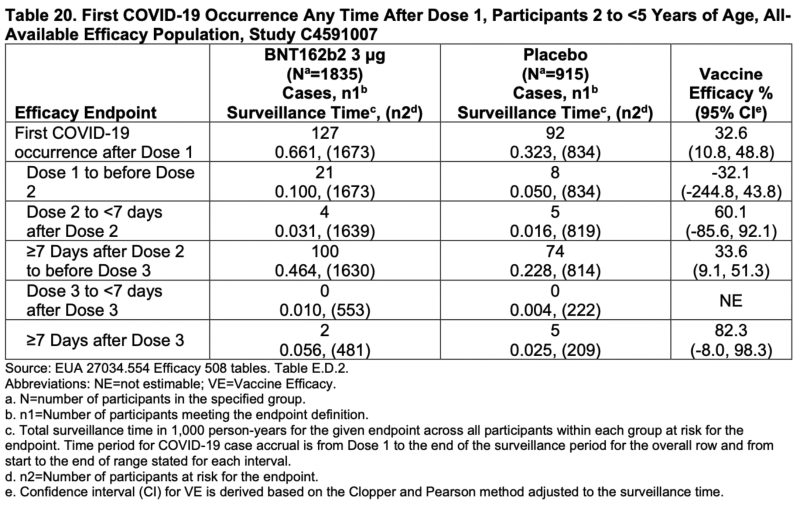
Aunque tres de los cuatro criterios de valoración principales tenían intervalos de confianza negativos, todavía requiere una cantidad significativa de caridad.
También vale la pena señalar que el período de tiempo entre la administración de la dosis 1 y la dosis 2 se asoció con una eficacia negativa en ambos grupos de edad.
Es probable que esto haya contribuido a los problemas de notificación de datos al calcular la efectividad de la vacuna en el mundo real. Cualquier caso que ocurra durante este período de tiempo se considera “no vacunado”, excepto en estos grupos de edad, que es cuando la eficacia está en su punto más bajo.
El hecho de que la FDA autorice estas vacunas para niños basándose en estos datos es simplemente imperdonable.
Los tamaños de muestra no cumplieron con su protocolo especificado en 21 casos.
Los cálculos de eficacia de la vacuna, incluso excluyendo los gigantescos intervalos de confianza, estuvieron muy por debajo del objetivo arbitrario del 50% que crearon para la autorización de uso de emergencia entre adultos.
La inclusión de los intervalos de confianza muestra la posibilidad de una eficacia negativa, que aunque es poco probable, aún es posible dada la cantidad extraordinariamente pequeña de casos tanto en el grupo de la vacuna como en el del placebo.
Simplemente usaron "inmunopuente" para inferir protección basada en la generación de anticuerpos, en lugar de tasas de eficacia predeterminadas.
Es otro indicador aterrador de cuán políticamente motivada se ha vuelto la FDA y cómo el activismo ha distorsionado la honestidad intelectual.
Los “expertos” están tan desesperados por mantener su reputación y evitar que personas influyentes como Eric Feigl-Ding, Angela Rasmussen y otros los etiqueten como “antivacunas” que parecen no estar dispuestos a denunciar fallas en el proceso de toma de decisiones.
Es a la vez difícil y fácil creer que esto fue todo lo que se necesitó para justificar un uso de vacunación de "emergencia" para grupos de edad con un riesgo extremadamente bajo de enfermedad grave.
Esta decisión, merecidamente, será una razón más para la erosión cada vez mayor de la confianza en los supuestos “expertos” de la salud pública, una vergüenza para los reguladores estadounidenses capturados por la política.
Publicado bajo un Licencia de Creative Commons Atribución Internacional
Para reimpresiones, vuelva a establecer el enlace canónico en el original Instituto Brownstone Artículo y Autor.










